МІНІ ОГЛЯД
Форпост проти раку: універсальні маркери лише для раку
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Шанхай 200233, Китай;2 відділення загальної хірургії, Перша афілійована лікарня Харбінського медичного університету, Харбін 150001, Китай;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, Китай;4 Народна лікарня Нінся-Хуейського автономного району, Нінсянський медичний університет, Іньчуань 750002, Китай;5Шанхайський клінічний центр охорони здоров’я та відділення загальної хірургії, лікарня Хуашань та Інститут метастазів раку та лабораторія епігенетики РНК, Інститути біомедичних наук, Шанхайський медичний коледж, Університет Фудань, Шанхай 200032, Китай
АНОТАЦІЯ
Рак є основною причиною смерті в усьому світі.Раннє виявлення раку може знизити смертність від усіх видів раку;однак для більшості типів раку відсутні ефективні біомаркери для раннього виявлення.Метилювання ДНК завжди було головним об’єктом інтересу, оскільки метилювання ДНК зазвичай відбувається перед іншими генетичними змінами, які можна виявити.Під час дослідження загальних ознак раку за допомогою нового керівного секвенування позиціонування для метилювання ДНК серія універсальних маркерів раку (UCOM) з’явилася як сильні кандидати для ефективного та точного раннього виявлення раку.У той час як клінічна цінність сучасних біомаркерів раку зменшується низькою чутливістю та/або низькою специфічністю, унікальні характеристики UCOMs забезпечують клінічно значущі результати.Перевірка клінічного потенціалу UCOM при раку легенів, шийки матки, ендометрія та уротелію додатково підтримує застосування UCOM при різних типах раку та різних клінічних сценаріях.Насправді застосування UCOM зараз активно досліджується з подальшою оцінкою раннього виявлення раку, допоміжної діагностики, ефективності лікування та моніторингу рецидивів.Молекулярні механізми, за допомогою яких UCOM виявляють рак, є наступними важливими темами для дослідження.Застосування UCOM у сценаріях реального світу також потребує впровадження та вдосконалення.
КЛЮЧОВІ СЛОВА
виявлення раку;скринінг раку;метилювання ДНК;епігенетика раку;біомаркери раку
Чому нам терміново потрібні нові біомаркери?
Після боротьби з раком протягом понад століття, рак все ще є найбільш смертоносною біологічною загрозою для людства.Рак залишається глобальною проблемою охорони здоров’я: у 2020 році було зафіксовано 19,3 мільйона нових випадків і майже 10 мільйонів смертей1. У 2020 році в Китаї було діагностовано 4,6 мільйона нових випадків раку, що становить 23,7% нових випадків раку в усьому світі, згідно з даними GLOBOCAN1.Крім того, у 2020 році в Китаї приблизно 3 мільйони смертей були пов’язані з раком, що становило 30% глобальних смертей, пов’язаних із раком1.Ця статистика показала, що Китай посідає перше місце за рівнем захворюваності та смертності від раку.Крім того, 5-річна виживаність при раку становить 40,5%, що в 1,5 рази нижче, ніж 5-річна виживаність у США2,3.Порівняно нижча виживаність і вищі показники смертності в Китаї, ніж у країнах з вищим індексом людського розвитку, свідчать про те, що терміново потрібна ефективна та економічно ефективна система профілактики раку та епіднагляду.Раннє виявлення раку є одним із найважливіших елементів системи охорони здоров’я.Раннє виявлення раку може покращити прогноз і виживаність на ранній стадії майже всіх типів раку4.Успішні стратегії скринінгу призвели до значного зниження рівня захворюваності та смертності від раку шийки матки, молочної залози, колоректального раку та простати.
Проте раннє виявлення раку – завдання не з легких.Дослідження біології та прогнозу раку на ранній стадії, виявлення та перевірка надійних біомаркерів раннього виявлення, а також розробка доступних і точних технологій раннього виявлення завжди були найбільшими перешкодами в цьому процесі4.Точне виявлення раку дозволяє відрізнити доброякісні утворення від злоякісних, що допомагає уникнути непотрібних процедур і полегшує подальше лікування хвороби.Сучасні стратегії раннього виявлення включають біопсію за допомогою ендоскопа, медичну візуалізацію, цитологію, імунологічні аналізи та тести на біомаркери5-7.Будучи нав’язливою та дорогою, біопсія за допомогою ендоскопа несуть за собою важкий тягар як основна медична процедура, яка покладається на професійний персонал.Подібно до цитології, обидва методи скринінгу залежать від медичних працівників і ґрунтуються на особистому судженні з ефективністю, яка далека від ідеальної8.Навпаки, імунотести є дуже неточними, враховуючи високий рівень хибнопозитивних результатів.Медична візуалізація, як тактика скринінгу, вимагає дорогого обладнання та кваліфікованих техніків.Отже, медична візуалізація вкрай обмежена через низьку доступність.З усіх цих причин біомаркери видаються кращим варіантом для раннього виявлення раку.
Листування: Іньшань Лі та Веньцян Ю
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ORCID ID: https://orcid.org/0009-0005-3340-6802 і
https://orcid.org/0000-0001-9920-1133
Одержано 22.08.2023 р.;прийнято 12 жовтня 2023 р.;
опубліковано онлайн 28 листопада 2023 р.
Доступно на www.cancerbiomed.org
©2023 Біологія та медицина раку.Творчі спільноти
Attribution-NonCommercial 4.0 Міжнародна ліцензія
В даний час біомаркери класифікуються як білки, маркери мутації ДНК, епігенетичні маркери, хромосомні аномалії, маркери РНК, отримані безпосередньо з пухлин, або фрагменти пухлин, отримані опосередковано з рідин організму.Білкові маркери є найбільш широко застосовуваними біомаркерами при скринінгу та діагностиці раку.Білкові біомаркери, як скринінгові біомаркери, обмежені схильністю до впливу доброякісних уражень, що призводить до гіпердіагностики та надмірного лікування, як повідомлялося про α-фетопротеїн і простатоспецифічний антиген (ПСА)9,10.РНК-маркери включають шаблони генетичної експресії та інші некодуючі РНК-маркери. Комбінацію маркерів генетичної експресії РНК можна виявити за допомогою зразків сечі, чутливість яких була далекою від задовільної (60%) для первинних пухлин, і виявлення яких може бути під впливом природи легкої деградації РНК у нормальному середовищі11.Генетичні та епігенетичні маркери стикаються з проблемою поширеності пухлин і обмеження типами раку.
Метилювання ДНК є сильним кандидатом як біомаркер раннього виявлення після того, як Фейнберг у 1983 році вперше пов’язав його з раком12. Аберації метилювання ДНК спостерігаються на всіх стадіях раку, навіть на передраковій стадії.Аберрантне гіперметилювання ДНК зазвичай відбувається на острівцях CpG в промоторах генів для протидії супресорам пухлини13,14.Дослідження також показали, що аномальне гіперметилювання ДНК бере участь у регуляції регуляторів розвитку15.Долина метилювання ДНК, яка зазвичай асоціюється з регуляторами розвитку та гіперметильованим раком, може переключити режим експресії генів на більш стабільний режим, залежний від метилювання ДНК, і зменшити зв’язок із метильованим гістоном H3K27me3 та пов’язаними полікомбними білками16,17.
Серед великої кількості опублікованих маркерів метилювання ДНК кілька успішно дебютували на ринку;однак поточні комерціалізовані маркери метилювання ДНК і діагностичні панелі ще не повністю розкрили потенціал раннього виявлення раку з багатьох причин18.Хоча здебільшого демонструють прийнятну продуктивність з використанням інформації з бази даних, ці біомаркери зазвичай працюють менш ідеально в реальному світі через те, що зразки в реальному світі часто є більш складними та не такими репрезентативними, як ті, що вибрані в базах даних.Було показано, що раннє виявлення мультиракового метилювання на основі секвенування наступного покоління має лише 16,8% і 40,4% чутливість у I та II стадіях раку відповідно19.Тести на раннє виявлення вимагають більшої стабільності та точніших біомаркерів.
Виявлення універсального маркера лише для раку (UCOM) за допомогою послідовного визначення позиціонування (GPS)
Незважаючи на десятиліття досліджень раку, задовільної профілактики та лікування не було реалізовано.Потрібні нові методології, щоб дозволити дослідникам ретельно оцінювати рак.За останні 23 роки 6 характерних ознак раку, таких як уникнення апоптозу, інвазія в тканини та метастазування тощо, було розширено до 14 шляхом включення таких функцій, як немутаційне епігенетичне перепрограмування та поліморфні мікробіоми20,21.Оскільки розкривається більше подробиць, пов’язаних із раком, у дослідження раку з’являється більше перспектив.Дослідження раку поступово вийшли на новий рівень у двох напрямках (спільність та індивідуальність).З розвитком прецизійної онкології в останні роки дослідження раку схиляються до індивідуальної цільової терапії та гетерогенності раку22.Таким чином, нещодавно ідентифіковані біомаркери раку були зосереджені в основному на конкретних типах раку, таких як рак шийки матки PAX623 і BMP3 для колоректального раку24.Ефективність цих біомаркерів, специфічних для типів раку, різна, але сприйнятливі особи все ще не можуть пройти скринінг на всі види раку одночасно через обмеження отримання біологічних зразків і високу вартість.Було б ідеально, якби ми змогли визначити єдиний надійний біомаркер, ефективний для всіх типів раку на початковій стадії.
Щоб досягти такої ідеальної мети, зі списку потенційних типів біомаркерів необхідно вибрати кращий кандидат на біомаркери.Відомо, що аберації метилювання ДНК серед усіх генетичних і епігенетичних профілів пов’язані з раком і є одними з найраніших, якщо не перших, аномалій, пов’язаних з раком, які виникають у хронологічному порядку.Дослідження метилювання ДНК почалося рано, але було перешкоджено відсутністю методів дослідження.Серед 28 мільйонів потенційних метильованих CpG-сайтів у геномі необхідно виявити контрольоване число та узгодити його з геномом, щоб краще зрозуміти пухлиногенез.Бісульфітне секвенування повного генома (WGBS), яке вважається золотим стандартом секвенування метилювання ДНК, може охопити лише 50% Cs у ракових клітинах через природу лікування бісульфітом, яке розриває фрагменти ДНК і знижує складність геному під час перетворення Cs-в-Ts25.Інші методи, такі як 450 тис. мікросхем, покривають лише 1,6% метилювання геному.На основі 450 тисяч даних панель виявлення метилювання ДНК має 35,4% чутливості для 6 типів раку I стадії26.Обмеження типів раку, низька продуктивність і шум, створюваний методами виявлення в аналітичному процесі, стали найбільшими перешкодами для панелей виявлення раку.
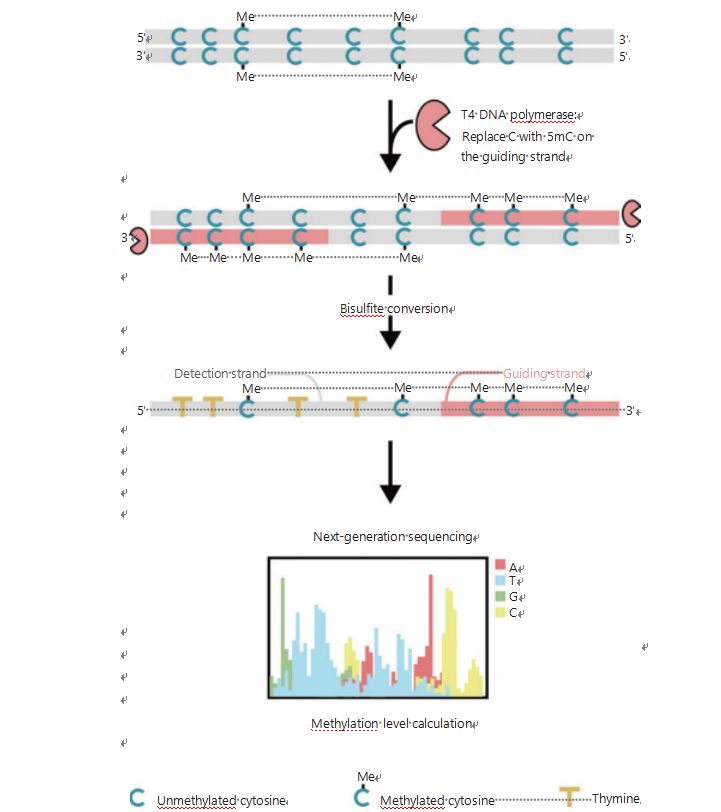
Щоб краще дослідити епігенетичні моделі клітин під час пухлиногенезу та метастазування, ми розробили унікальний GPS для виявлення метилювання ДНК у всьому геномі, який охоплює до 96% сайтів CpG за 0,4 мільярда читань25.GPS — це двосторонній метод секвенування з використанням 3'-кінця фрагмента ДНК неконвертованих метилцитозинів після обробки бісульфітом, який керує вирівнюванням метилювання ДНК 5'-кінця через парне секвенування (рис. 1)25.Направляючий ланцюг метил-цитозин, діючи як шаблонний ланцюг, допомагає у вирівнюванні регіону з високим GC, що відновлює більшість залишених даних секвенування в традиційному WGBS.Функція високого охоплення GPS надає величезну кількість інформації про метилювання ДНК, що дозволяє нам досліджувати профілі метилювання раку зі значно вищою роздільною здатністю в раніше недостатньо досліджених регіонах.
GPS надає нам потужний інструмент для дослідження гомогенності раку, який може значно спростити дослідження раку та потенційно знайти універсальне пояснення пухлиноутворення та метастазування.Під час аналізу даних GPS клітинних ліній раку часто зустрічався унікальний феномен.Існувала низка областей, які виявилися аномально гіперметильованими в різних типах зразків раку.Ця несподівана знахідка згодом була підтверджена як UCOM.Було проаналізовано понад 7000 зразків із 17 типів раку в базі даних Атласу геному раку (TCGA), серед яких ми ідентифікували перший UCOM, HIST1H4F, пов’язаний з гістонами ген, який гіперметильований у всіх типах раку27.Потім серію UCOM було знайдено та підтверджено в базі даних TCGA, базі даних Gene Expression Omnibus (GEO) і реальних клінічних зразках.На даний момент HIST1H4F, PCDHGB7 і SIX6 були знайдені та перевірені як UCOM.Несподіване відкриття UCOMs пропонує потужну відповідь на необхідність раннього виявлення раку.UCOM надають рішення для виявлення кількох видів раку за одним маркером.
Характеристика УКОМ
Після валідації було показано, що UCOM демонструють чотири основні характеристики, які дозволяють UCOM перевершувати ефективність сучасних біомаркерів (рис. 2).
Унікальний для злоякісної пухлини
UCOM є унікальними для ракових або передракових уражень і на них не впливають нормальні фізіологічні зміни.Деякі з поточних маркерів, пов’язаних із раком, які широко застосовуються для раннього виявлення та/або скринінгу, призвели до гіпердіагностики.Підвищений рівень ПСА, клінічно акредитований інструмент скринінгу, також виявляється при доброякісних станах, таких як гіперплазія простати та простатит10.Надмірна діагностика та, як наслідок, надмірне лікування призводять до зниження якості життя через кишкові, сечові та статеві ускладнення28.Інші білкові біомаркери, які широко використовуються в клінічних умовах, такі як CA-125, не принесли суттєвих переваг, спричинивши надмірну діагностику та надмірне лікування29.Висока специфічність UCOM щодо злоякісних пухлин дозволяє уникнути цих недоліків.UCOM, PCDHGB7, ефективно відрізняє плоскоклітинні внутрішньоепітеліальні ураження високого ступеня (HSIL) і рак шийки матки від нормальних зразків і плоскоклітинних внутрішньоепітеліальних уражень низького ступеня (LSIL), тоді як більшість інших біомаркерів можуть лише відрізнити рак шийки матки від нормальних зразків30.Хоча PCDHGB7 не виявляє суттєвих відмінностей між нормальним ендометрієм і гіперплазією ендометрія, значні відмінності виявляються між нормальним ендометрієм і атиповою гіперплазією, і навіть більші відмінності виявляються між нормальним ендометрієм і раком ендометрія (EC) на основі PCDHGB731.UCOM є унікальними для злоякісних уражень у базах даних і клінічних зразках.З точки зору пацієнта, унікальні UCOM знижують поріг для розуміння складних ознак різних поганих нестабільних біомаркерів і відповідного занепокоєння під час процесу оцінки.З точки зору клініциста, унікальні UCOM диференціюють злоякісні новоутворення від доброякісних, що допомагає сортувати пацієнтів і зменшує кількість непотрібних медичних процедур і надмірного лікування.Таким чином, унікальні UCOM зменшують надмірність медичної системи, усувають системні дистреси та надають більше медичних ресурсів тим, хто їх потребує.
Рисунок 1. Схема робочого процесу GPS для виявлення метилювання ДНК25.Сіра лінія: вхідна послідовність ДНК;червона лінія: ДНК, оброблена ДНК-полімеразою Т4 із заміною цитозину на 5′-метилцитозин на 3′-кінці входу;синій C з Me: метильований цитозин;синій C: неметильований цитозин;жовтий Т: тимін25.
Все або нічого
UCOM присутні лише в ракових клітинах і стабільно виявляються майже в усіх ракових клітинах.Було підтверджено, що HIST1H4F є гіперметильованим майже у всіх типах пухлин, але не в нормальних зразках27.Подібним чином було показано, що PCDHGB7 і SIX6 гіперметильовані у всіх зразках пухлин, але не в нормальних зразках30-32.Ця унікальна характеристика значно покращує роботу UCOM щодо межі виявлення та чутливості.Лише 2% ракових клітин можна диференціювати у зразках, що робить UCOM набагато більш чутливим біомаркером, ніж більшість існуючих біомаркерів30. Як біомаркер, який використовується для виявлення колоректального раку, мутації KRAS існують лише приблизно у 36% випадків колоректального раку, що свідчить про поганий діагностичний потенціал33.Низька поширеність мутацій KRAS у колоректальному раку обмежує KRAS у комбінації з іншими біомаркерами.Насправді комбінація біомаркерів спочатку може здаватися багатообіцяючою, але не завжди дає задовільний результат, демонструючи набагато більший шум під час аналізу виявлення та зазвичай передбачає більш складні експериментальні процедури.Навпаки, PCDHGB7 та інші UCOM існують у всіх видах раку.UCOM виявляє ракові компоненти в різних типах зразків раку з надзвичайною точністю, усуваючи складні процеси аналізу шумозаглушення.Виявити рак у великій пробі неважко, але надзвичайно складно виявити рак у невеликій пробі.UCOM здатні виявляти невелику кількість раку.
Рисунок 2 Характеристики UCOM.
Виявлення раку, що передує патологічним змінам
UCOM можуть бути виявлені в передраковій стадії до патологічних змін.Будучи епігенетичними біомаркерами, аномалії UCOM виникають на більш ранній стадії, ніж фенотипові аномалії, і виявляються протягом пухлиногенезу, прогресування та метастазування34,35.Чутливість UCOM з часом покращує продуктивність UCOM у виявленні раку на ранніх стадіях і передракових уражень.Виявлення раку на ранніх стадіях на основі біопсії та цитології може бути складним навіть для найдосвідченіших патологів.Одна біопсія, отримана за допомогою кольпоскопії, була позитивною в 60,6% зразків HSIL+.Додаткові біопсії необхідні для множинних уражень для підвищення чутливості36.Навпаки, UCOM, PCDHGB7, має чутливість 82% для зразків HSIL+, що перевищує чутливість біопсії та більшості біомаркерів30.Маркер метилювання, FAM19A4, має чутливість 69% для CIN2+, що подібно до цитології, але не може відрізнити CIN1 від нормальних зразків37.Показано, що UCOM є набагато чутливішим біомаркером раннього виявлення.Порівняно з патологоанатомами, що базуються на досвіді, UCOM мають кращу чутливість виявлення раку на ранніх стадіях, що, у свою чергу, сприяє покращенню прогнозу раку та виживаності30.Крім того, UCOM пропонують платформу виявлення, яка доступна для регіонів, де бракує досвідчених патологів, і значно підвищує ефективність виявлення.Завдяки уніфікованим процедурам відбору проб і виявлення виявлення UCOM дає стабільні та прості для інтерпретації результати, які краще підходять для протоколу скринінгу, що потребує менше професійного персоналу та медичних ресурсів.
Легко виявити
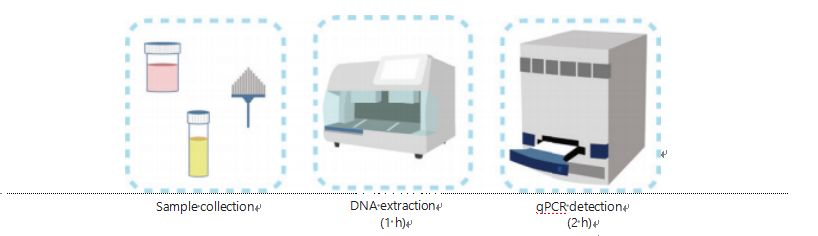
Сучасні методи виявлення метилювання ДНК є складними та трудомісткими.Більшість методів вимагає бісульфітного перетворення, що спричиняє втрату якості зразка та, можливо, дає нестабільні та неточні результати.Погана відтворюваність, викликана лікуванням бісульфітом, потенційно може призвести до плутанини для лікарів і пацієнтів і ще більше заважати подальшим спостереженням та/або стратегіям лікування.Тому ми додатково модифікували метод виявлення UCOM, щоб уникнути проблематичної бісульфітної обробки зразків, відповідати вимогам клінічного застосування та покращити доступність.Ми розробили новий метод із застосуванням чутливих до метилювання рестрикційних ферментів у поєднанні з флуоресцентною кількісною ПЛР у реальному часі (Me-qPCR) для кількісної оцінки статусу метилювання UCOM протягом 3 годин за допомогою простих процедур (рис. 3).Me-qPCR може включати кілька типів зразків, наприклад клінічний збір рідин організму та самостійний збір зразків сечі.Зібрані клінічні зразки можна обробляти, зберігати та легко переходити до виявлення за допомогою стандартизованої та автоматизованої екстракції ДНК.Екстраговану ДНК можна нанести безпосередньо на платформу Me-qPCR для реакції в одному резервуарі та отримання результатів кількісного визначення.Після простого аналізу результатів за допомогою діагностичних моделей, підігнаних і підтверджених для конкретних типів раку, остаточне визначення результатів виявлення UCOM інтерпретується та представляється як напівкількісне значення.Платформа Me-qPCR перевершує традиційне бісульфітне піросеквенування у виявленні UCOM, заощаджуючи 3 години перетворення бісульфіту відповідно до протоколу набору EZ DNA Methylation-Gold.Інноваційна платформа виявлення метилювання робить виявлення UCOM стабільнішим, точнішим і доступнішим30.
Рисунок 3 Процес виявлення UCOM.Типи зразків включають професійно відібрану БАЛП, щіточку для мазка та/або власноруч зібрану сечу.Процес екстракції ДНК можна пристосувати до автоматичного екстрактора, продукт якого можна безпосередньо виявити за допомогою КПЦР.
Застосування UCOMs
Рак легенів
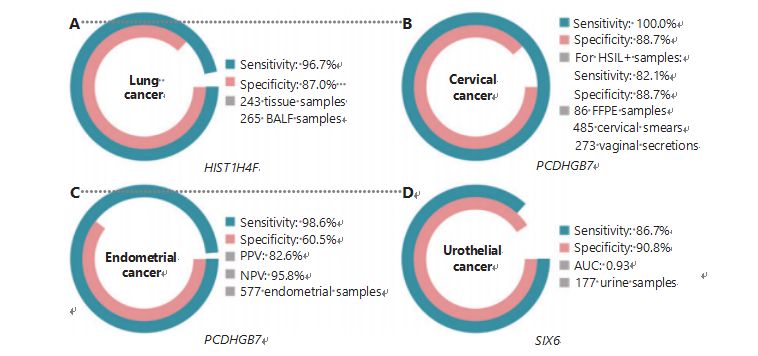
Рак легенів є другим за частотою діагностуванням і найбільш летальним раком у світі, на нього припадає 11,4% нових випадків і 18,0% нових смертей1.Серед усіх діагнозів 85% припадає на недрібноклітинний рак легені (НДРЛ) і 15% – на дрібноклітинний рак легені (МКРЛ), який має вищий рівень злоякісності38.Комп’ютерна томографія з низькими дозами (LDCT) є наразі рекомендованим методом скринінгу раку легенів, який, як було показано, покращує раннє виявлення та знижує смертність6;однак, через низьку специфічність і погану доступність, LDCT ще не служив задовільним методом скринінгу, як і інші поширені маркери раку, такі як CEA39.Витрати та потенційна можливість невстановлених діагнозів і помилкових діагнозів стратегії скринінгу LDCT перешкоджають просуванню скринінгу на рак легенів40.HIST1H4F, UCOM, має величезний потенціал як біомаркер раннього виявлення в зразках бронхоальвеолярної рідини (БАЛ)27.HIST1H4F гіперметильований в аденокарциномі легенів і плоскоклітинному раку легенів зі специфічністю виявлення 96,7% і чутливістю 87,0% (рис. 4A), а також винятковою ефективністю для стадії I раку27.HIST1H4F має специфічність 96,5% і чутливість 85,4% для NSCLC і 96,5% і 95,7% відповідно для SCLC27.Крім того, зразки восьми інших типів раку, включаючи рак підшлункової залози та колоректальний рак, підтвердили, що HIST1H4F гіперметильований у всіх восьми типах27.
Рак шийки матки
Рак шийки матки був четвертим за частотою діагностуванням раком і четвертою основною причиною смерті від раку серед жінок у 2020 році, на нього припадало 3,1% нових випадків і 3,4% смертей, пов’язаних з раком, у всьому світі1.Щоб ліквідувати рак шийки матки до 2030 року, як пропонує ВООЗ, необхідно раннє виявлення раку шийки матки.При виявленні на ранній стадії 5-річна виживаність при інвазивному раку шийки матки досягає 92%41.Рекомендації Американського онкологічного товариства (ACS) пропонують цитологічні тести шийки матки, первинні тести на ВПЛ або котести для скринінгу42.Цервікальна цитологія є інвазивною і може виявити лише 63,5% випадків CIN2+37.
PCDHGB7, навпаки, показав набагато кращі результати при використанні мазків Папаніколау та вагінальних виділень і може ефективно диференціювати HSIL від LSIL на ультраранній стадії.Лише PCDHGB7 має чутливість 100,0% і специфічність 88,7% для раку шийки матки (рис. 4B), а також 82,1% чутливість і 88,7% специфічність для зразків HSIL+30.PCDHGB7 також має 90,9% чутливість і 90,4% специфічність у зразках вагінального секрету для раку шийки матки, які набагато легше зібрати30.У поєднанні з тестом HPV високого ризику (hr) або цитологічним тестом Thinprep (TCT) PCDHGB7 має підвищену чутливість на 95,7% і специфічність на 96,2%, значно перевищуючи показники тесту hrHPV (20,3%), TCT (51,2%) ), і два разом (57,8%) для раку шийки матки30.Також було показано, що PCDHGB7 гіперметильований у 17 типах раку з бази даних TCGA, що вказує на його придатність для сімейства UCOM30.
Малюнок 4 У широкомасштабних клінічних дослідженнях UCOM були підтверджені для чотирьох типів раку.A. Ефективність HIST1H4F, UCOM, у виявленні раку легенів у 508 зразках.B. Ефективність PCDHGB7, UCOM, у виявленні раку шийки матки у 844 зразках.C. Ефективність PCDHGB7, UCOM, у виявленні раку ендометрію 577 зразків ендометрію Папаніколау та щітки Тао.D. Ефективність SIX6, UCOM, у виявленні уротеліального раку 177 зразків.
EC
ЕК є одним із найпоширеніших видів раку жіночої репродуктивної системи в усьому світі, з оцінками 4,2 мільйона нових випадків та 1% смертей, пов’язаних із раком, щорічно1.При успішній діагностиці на ранній стадії ЕК є виліковним і має 5-річну виживаність 95% для стадії I раку.Пацієнти з такими симптомами, як аномальна маткова кровотеча, отримують періодичне клінічне обстеження та проходять інвазивні та болючі процедури біопсії, незважаючи на те, що лише у 5–10% зрештою розвивається EC43.Трансвагінальне ультразвукове дослідження, як загальний метод виявлення, є дуже ненадійним через його нездатність диференціювати доброякісні зміни ендометрія від злоякісних та високу частоту хибнопозитивних результатів44.
Було проведено паралельне порівняння сироваткового CA-125, широко впровадженого біомаркера EC, і PCDHGB7.Сироватка CA-125 мала чутливість 24,8%, що свідчить про те, що CA-125 є неадекватним маркером для EC, незважаючи на специфічність 92,3%31.Виявлення PCDHGB7 з використанням зразків щітки Пап дало чутливість 80,65% і специфічність 82,81% для стадій ECatall, тоді як щітка Tao мала чутливість 61,29% і специфічність 95,31%31.Діагностична модель PCDHGB7, заснована на Me-qPCR, показала чутливість 98,61%, специфічність 60,5% і загальну точність 85,5%, використовуючи зразки щіток Pap і Tao (Рисунок 4C)31.
Уротеліальний рак
Уротеліальний рак, який складається з раку сечового міхура, ниркової миски та сечоводу, був сьомим за частотою діагностованим раком у 2020 році в усьому світі, викликаючи 5,2% нових випадків і 3,9% смертей1.Уротеліальний рак, понад 50% з яких припадає на рак сечового міхура, був четвертим найбільш часто діагностованим раком у Сполучених Штатах у 2022 році, на нього припадало 11,6% нових діагностованих випадків3.Приблизно 75% випадків раку сечового міхура класифікується як неінвазивний рак сечового міхура, обмежений слизовою або підслизовою45.Цистоскопічна біопсія є золотим стандартом діагностики уротеліального раку за допомогою флуоресцентної гібридизації in situ (FISH) і цитологічних тестів.FISH і цитологія мають низьку діагностичну ефективність, а цистоскопія є інтрузивною та має основний ризик пропуску мікроуражень, неправильної інтерпретації уражень і потенційного спричинення поширення або рецидиву раку46.Раніше валідований UCOM, PCDHGB7, також було показано, що гіперметильований при уротеліальному раку, з площею під кривою 0,86, що свідчить про потенційну діагностичну можливість30.Для подальшої перевірки більшої кількості UCOM і кращої адаптації до більшої кількості типів зразків SIX6, новий UCOM, був досліджений і продемонстрував чудовий діагностичний потенціал у ранньому виявленні уротеліального раку за допомогою зразків сечі на платформі Me-qPCR.Виявлення SIX6 за допомогою зразків сечі продемонструвало конкурентну чутливість 86,7% і специфічність 90,8% (рис. 4D), при цьому воно неінвазивне і його легко отримати32.Потенціал SIX6 у моніторингу метастазів та оцінці ефективності лікування зараз досліджується.
Майбутнє і виклики
UCOM має високу ефективність у діагностичному потенціалі багатьох видів раку, але ще багато роботи.Ми розширюємо список UCOM і активно перевіряємо UCOM на більшу кількість типів раку, включаючи ті, які традиційно важко виявити.Результати валідації з баз даних TCGA ще більше підтвердили застосування UCOM у більшій кількості типів раку та інших ситуаціях.Під час попереднього дослідження було показано, що UCOM мають потужний діагностичний потенціал для холангіокарцином і аденокарцином підшлункової залози, які майже неможливо діагностувати на ранній стадії за допомогою сучасних методів скринінгу32,47.Здатність виявляти рідкісні види раку за допомогою UCOMs може бути використана з циркулюючою ДНК пухлини (ctDNA) за допомогою вдосконаленої платформи для рідкої біопсії48.Дослідження з використанням панелі виявлення панраку на основі ДНК плазми крові дало чутливість 57,9%49.Незважаючи на високу специфічність, загальна продуктивність показує, що ще є можливості для вдосконалення.
Унікальні характеристики UCOM також підтримали дослідження потенціалу UCOM в оцінці ефективності лікування та моніторингу рецидивів.Згідно з Критеріями оцінки відповіді при солідних пухлинах (RECIST), медична візуалізація є рекомендованою методологією для моніторингу рецидивів та оцінки ефективності лікування, тоді як для оцінки використовуються лише онкомаркери50.Насправді, однак, підходи до візуалізації значною мірою залежать від частоти та часу, що наражає пацієнтів на більш високий ризик і витрати51,52.Було підтверджено, що SIX6 служить предиктором метастазів раку молочної залози32.Моніторинг ctDNA на основі рідкої біопсії дає змогу в режимі реального часу спостерігати за мінімальними залишковими захворюваннями за кілька місяців до радіологічного виявлення, ідеально затримуючи та запобігаючи прогресуванню раку, пов’язаному з рецидивом53.Попередні результати показують, що UCOM відображають рівень ракового гіперметилювання в реальному часі відразу після операції та лікування32.Висока чутливість, яку демонструють UCOM, і можливість застосування в багатьох неінтрузивних типах зразків дозволяє UCOM служити точним біомаркером для моніторингу рецидивів, зберігаючи при цьому високу комплаєнсність пацієнтів.
Водночас публічна доступність тесту є ще однією важливою проблемою, яка вимагає додаткових зусиль.У той час як співпраця UCOM щодо виявлення була запроваджена в більшій кількості лікарень з надією принести користь більшій кількості пацієнтів, безкоштовне виявлення та скринінг активно проводилися в сільській місцевості Китаю.UCOM потребують покращеної доступності, щоб вважатися можливим інструментом скринінгу, особливо для слаборозвинених районів.
Хоча результати застосування UCOM щодо раннього виявлення є перспективними, існує багато невідомих про UCOM.При активному дослідженні необхідні додаткові дослідження щодо того, чому UCOM повсюдно присутні в ракових захворюваннях.Основні механізми епігенетичної регуляції, що лежать в основі UCOMs, заслуговують на подальше дослідження, яке може виправдати новий напрямок для терапії раку.Повертаючись до взаємодії між гомогенністю та гетерогенністю пухлини, нас цікавить, чому UCOM можуть бути винятком із більшості біомаркерів раку, які тісно пов’язані з конкретними типами раку.Роль ідентифікованих UCOM аберацій метилювання ДНК у пухлиногенезі, прогресії пухлини та метастазах не була визначена в процесі втрати та відновлення клітинної ідентичності, і вимагає ретельного обстеження.Інший великий інтерес полягає в об’єднанні ознаки однорідності UCOM з унікальними для тканини маркерами в надії наблизитися до точного виявлення слідів раку та ідентифікації походження пухлинної тканини у зворотному порядку.UCOM може бути ідеальним інструментом для запобігання раку, виявлення раку, а також потенційного захисту та усунення раку.
Грантова підтримка
Ця робота була підтримана Національною ключовою програмою досліджень і розробок Китаю (грант № 2022BEG01003), Національним фондом природничих наук Китаю (гранти № 32270645 і 32000505), грантом Комісії охорони здоров’я провінції Хейлунцзян (грант № 2020-111) , а також грант від Науково-технологічного інституту Хезе (грант № 2021KJPT07).
Заява про конфлікт інтересів
Вей Лі є директором з досліджень і розробок Shanghai Epiprobe Biotechnology Co., Ltd. Веньцян Ю є членом Науково-консультативної ради Epiprobe.W. Yu та Epiprobe схвалили патенти, що очікують на розгляд, пов’язані з цією роботою.Усі інші автори заявляють про відсутність конкуруючих інтересів.
Авторські внески
Задумали та розробили проект: Ченчен Цянь та Веньцян Ю.
Написав статтю: Ченчен Цянь.
Зробив ілюстрації: Chengchen Qian.
Рецензували та редагували рукопис: Сяолун Цзоу, Вей Лі, Іньшань Лі та Веньцян Ю.
Список літератури
1. Sung H, Ferlay J, Siegel RL, LaversanneM, Soerjomataram I, Jemal A та ін.Глобальна статистика раку 2020: оцінки GLOBOCAN
захворюваності та смертності в усьому світі від 36 видів раку в 185 країнах.CA Cancer J Clin.2021 рік;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S та ін.Статистика раку в Китаї та Сполучених Штатах, 2022: профілі, тенденції та детермінанти.Chin MedJ (англ.).2022;135: 584-90.
3. Сігель Р.Л., Міллер К.Д., ВаглеНС, ДжемалА.Статистика раку, 2023. CA Cancer J Clin.2023;73: 17-48.
4. Кросбі Д., Бхатія С., Бріндл К. М., Кусенс Л. М., Дайв К., Ембертон М. та ін.Раннє виявлення раку.Наука.2022;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Стратегії для
скринінг колоректального раку.Гастроентерологія.2020 рік;158: 418-32.
6. Тануе Л.Т., Таннер Н.Т., Гулд М.К., Сільвестрі Г.А.Скринінг раку легенів.Am J Respir Crit Care Med.2015 рік;191: 19-33.
7. Bouvard V, WentzensenN, Mackie A, Berkhof J, BrothertonJ, Giorgi-Rossi P, et al.Погляд IARC на скринінг раку шийки матки.N EnglJ Med.2021 рік;385: 1908-18.
8. Сюе П, Нг МТА, Цяой.Проблеми кольпоскопії для скринінгу раку шийки матки в LMIC та рішення штучного інтелекту.BMC Med.2020 рік;18: 169.
9. Джонсон П., Чжоу К., Дао Д.Й., Ло Ю.М.Д.Циркулюючі біомаркери в діагностиці та лікуванні гепатоцелюлярної карциноми.Nat Rev Gastroenterol Hepatol.2022;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Раннє виявлення раку передміхурової залози на основі сироваткового PSA в Європі та в усьому світі: минуле, теперішнє та майбутнє.Nat Rev Urol.2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
та ін.Розробка мультиплексного РНК-тесту сечі для виявлення та стратифікації перехідноклітинного раку сечового міхура.Clin Cancer Res.2008 рік;14: 742-9.
12. Фейнберг А. П., Фогельштейн Б. Гіпометилювання відрізняє гени деяких видів раку людини від їх звичайних аналогів.природа1983 рік;301: 89-92.
13. Ng JM, Yu J. Промотор гіперметилювання генів-супресорів пухлин як потенційних біомаркерів колоректального раку.IntJ Mol Sci.2015 рік;16: 2472-96.
14. Естеллер М. Епігеноміка раку: метиломи ДНК і карти модифікації гістонів.Nat Rev Genet.2007 рік;8: 286-98.
15. Нісіяма А, Наканіші М. Навігація в ландшафті метилювання ДНК раку.Тенденції Genet.2021 рік;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P та ін.Епігеномний аналіз багатолінійної диференціації ембріональних стовбурових клітин людини.Стільниковий.2013 рік;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X та ін.Загальногеномний аналіз показує роль Polycomb у сприянні гіпометилюванню долин метилювання ДНК.Genome Biol.2018 рік;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
та ін.Аналіз метилювання ДНК при раку: місце розташування знову.Nat Rev Clin Oncol.2018 рік;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D, et al.Клінічна валідація цільового тесту на раннє виявлення раку на основі цільового метилювання з використанням незалежного набору валідації.Енн Онкол.2021 рік;32: 1167-77.
20. Ханахан Д., Вайнберг Р.А.Ознаки раку.Стільниковий.2000;100: 57-70.
21. Ханахан Д. Характерні ознаки раку: нові виміри.Рак Discov.2022;12: 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Precision oncology: who, how, what, when, and when not?Навчальна книга Am Soc Clin Oncol.2017: 160-9.
23. Liu H, Meng X, Wang J. Кількісне метилювання в реальному часі
виявлення гена PAX1 при скринінгу раку шийки матки.IntJ Gynecol Cancer.2020 рік;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP, et al.Мультицільове дослідження ДНК для скринінгу колоректального раку.N EnglJ Med.2014 рік;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S та ін.Позиціонування керівництва
секвенування визначає аберрантні моделі метилювання ДНК, які змінюють ідентичність клітини та мережі нагляду за імунною пухлиною.Геном
рез.2019 рік;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY та ін.Ненав’язливе виявлення мультиракових захворювань за допомогою секвенування метилювання циркулюючої безклітинної ДНК (THUNDER): розробки та незалежні перевірочні дослідження.Енн Онкол.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B та ін.Гени, пов’язані з гістонами, є гіперметильованими при раку легенів і гіперметильованими
HIST1H4F може служити біомаркером раку.Cancer Res.2019 рік;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V, et al.Вплив скринінгу на простатоспецифічний антиген на якість життя.N EnglJ Med.2012 рік;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Клінічна ефективність скринінгових тестів на біомаркери раку, які пропонуються як самооплачувані медичні послуги: систематичний огляд.Eur J Public Health.2016 рік;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z та ін.
Гіперметильований PCDHGB7 як універсальний маркер раку та його застосування в ранньому скринінгу раку шийки матки.Clin Transl Med.2021 рік;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X та ін.Гіперметильований PCDHGB7 як біомаркер для раннього виявлення раку ендометрію в зразках щіток ендометрію та зіскрібках шийки матки.Front Mol Biosci.2022;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F та ін.Взаємно
ексклюзивна епігенетична модифікація на SIX6 з гіперметилюванням для передракової стадії та відстеження появи метастазів.Сигнал Transduct Target Ther.2022;7: 208.
33. Huang L, Guo Z, Wang F, Fu L. KRAS мутація: від нелікарської до медикаментозної при раку.Сигнал Transduct Target Ther.2021 рік;6: 386.
34. Бєлінський С.А., Нікула К.Дж., ПалмізаноВА, МіхельсР, СаккоманноГ, ГабріельсонЕ та ін.Аберрантне метилювання p16(INK4a) є ранньою подією при раку легенів і потенційним біомаркером для ранньої діагностики.Proc Natl Acad Sci U SA.1998 рік;95: 11891-6.
35. Робертсон К.Д.Метилювання ДНК і захворювання людини.Nat Rev Genet.2005 рік;6: 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C та ін.Багаторазові біопсії та виявлення передвісників раку шийки матки при кольпоскопії.J Clin Oncol.2015 рік;33: 83-9.
37. Де Штрупер Л.М., Мейєр Ч.Дж., Беркхоф Дж., Хесселінк А.Т., Снайдерс
PJ, Steenbergen RD та ін.Аналіз метилювання FAM19A4
ген у зіскрібках шийки матки є дуже ефективним у виявленні шийки матки
карциноми та поширені ураження CIN2/3.Рак Prev Res (Phila).2014 рік;7: 1251-7.
38. Тай А. А., Соломон Б. Дж., Секвіст Л. В., Гейнор Дж. Ф., Хіст Р. С..Рак легенів.Ланцет.2021 рік;398: 535-54.
39. Grunnet M, Sorensen JB.Карциноембріональний антиген (СЕА) як онкомаркер при раку легенів.Рак легенів.2012 рік;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L, et al.Скринінг раку легенів, версія 3.2018, NCCN Clinical Practice Guidelines in Oncology.J Natl Compr Canc Netw.2018 рік;16: 412-41.
41. Американське ракове товариство.Цифри та факти про рак.Атланта, Джорджія, США: Американське товариство раку;2023 [оновлено 2023 1 березня;цитовано 2023 серпня 22].
42. FonthamMETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A та ін.Скринінг раку шийки матки для осіб із середнім ризиком: оновлення рекомендацій 2020 року від Американського онкологічного товариства.CA Cancer J Clin.2020 рік;70: 321-46.
43. Кларк М. А., Лонг Б. Дж., Дель Мар Морілло А., Арбін М., Баккум-Гамез Дж. Н., Венценсен Н. Асоціація ризику раку ендометрія з кровотечею в постменопаузі у жінок: систематичний огляд і мета-аналіз.JAMA Intern Med.2018 рік;178: 1210-22.
44. Якобс І, Джентрі-Махарадж А, Бернелл М, Манчанда Р, Сінгх Н,
Шарма А та ін.Чутливість трансвагінального ультразвукового скринінгу
раку ендометрію у жінок у постменопаузі: дослідження типу «випадок-контроль» у когорті UKCTOCS.Ланцет Онкол.2011 рік;12: 38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ та ін.Рекомендації Європейської асоціації урологів щодо неінвазивного раку сечового міхура (TaT1 та карциноми in situ) -
Оновлення 2019 року.Євро Урол.2019 рік;76: 639-57.
46. Арагон-Чінг Дж.Б.Проблеми та досягнення в діагностиці, біології та лікуванні уротеліальних карцином верхнього тракту та сечового міхура.Урол Онкол.2017 рік;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Холангіокарцинома – розвиваються концепції та терапевтичні стратегії.Nat Rev Clin Oncol.2018 рік;15: 95-111.
48 Ye Q, Ling S, Zheng S, Xu X. Рідка біопсія в гепатоцелюлярній
карцинома: циркулюючі пухлинні клітини та циркулююча пухлинна ДНК.Мол Рак.2019 рік;18: 114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K та ін.Пан-рак
виявлення ДНК циркулюючої пухлини у понад 10 000 китайських пацієнтів.Нац комун.2021 рік;12:11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R та ін.Нові критерії оцінки відповіді при солідних пухлинах: переглянуті рекомендації RECIST (версія 1.1).Eur J Рак.2009 рік;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST - навчання з минулого, щоб будувати майбутнє.Nat Rev Clin Oncol.
2017 рік;14: 187-92.
52. Сеймур Л, Богаертс Дж, Перроне А, ФордР, Шварц ЛХ, Мандрекар С та ін.iRECIST: рекомендації щодо критеріїв відповіді для використання в дослідженнях
тестування імунотерапевтичних засобів.Ланцет Онкол.2017 рік;18: e143-52.
53. PantelK, Alix-Panabières C. Рідина біопсія та мінімальна залишкова хвороба – останні досягнення та наслідки для лікування.Nat Rev Clin Oncol.2019 рік;16: 409-24.
Цитуйте цю статтю як: Qian C, Zou X, Li W, Li Y, Yu W. Форпост проти раку: універсальні маркери лише для раку.Cancer Biol Med.2023;20: 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Час публікації: травень-07-2024